


新加坡医疗器械的监管机构是新加坡卫生科学局(Health Sciences Authority, HSA)。HSA隶属于新加坡卫生部(Ministry of Health (MOH) Singapore) ,负责监管西药、医疗器械、辅助健康产品、化妆品等产品的新加坡法定机构。
如果制造商在新加坡有分公司即新加坡当地主体(local entity company),则由当地主体进行申报/注册;如果制造商在新加坡没有当地主体,则必须指定一名当地代表作为注册人,一系列的产品申报/注册申请工作将由注册人进行,并负责上市后的一些活动。
根据2007年的健康产品法(Health Product Act),“医疗器械” 指:
(1)任何仪器、器具、工具、机器、器具、植入物、体外试剂、软件、材料或其他类似或相关物品,其制造商打算单独或组合用于人类的一个或多个特定目的:
01
任何疾病的诊断、预防、监测、治疗或缓解;
02
损伤的诊断、监测、治疗或减轻或补偿;
03
主要用于医学目的的解剖结构或生理过程的研究、替换、修改或支持;
04
支持或维持生命;
05
妊娠控制;
06
医疗器械的消毒;
07
为了医学或诊断目的,通过对来源于人体的标本进行体外检查来提供信息,并且其不能通过药理学、免疫学或代谢手段在人体内或在人体上实现其主要预期作用,但可以通过这种手段辅助其功能,并且其不是细胞、组织或基因治疗产品。
(2) 包括以下条款:
01
用于修改或固定身体任何部位的任何植入物;
02
任何可注射的真皮填充剂或粘膜填充剂;
03
旨在通过侵入性手段去除或降解脂肪的任何仪器、装置、工具、机器或器具。
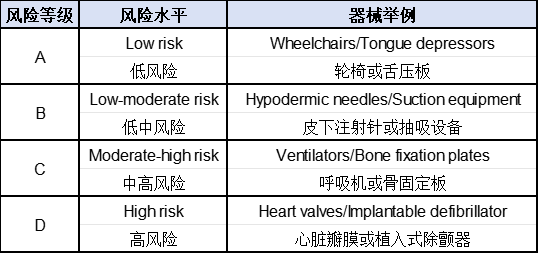
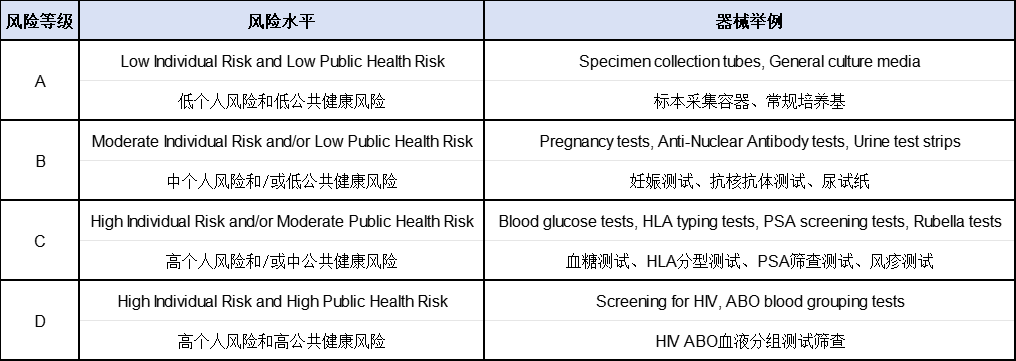
新加坡医疗器械的分类规则以全球医疗器械协调工作组(GHTF)建议为基础。在新加坡,医疗器械大致分为:常规医疗器械和体外诊断器械(IVD) 两大类;按安全风险高低,又分为A、B、C、D四个类别。A类免除产品注册需进行豁免清单登记,BCD类必须通过HSA进行注册审批。
常规医疗器械分类
体外诊断医疗器械分类
原产国批准
原产国注册并不是新加坡注册的先决条件,但如果有全球医疗器械协调工作组(GHTF)五个创始成员国(欧盟、澳大利亚、加拿大、日本和美国)的任意一个国家注册证,能够加速在新加坡的注册。
参考国批准
如果医疗器械获得以下一个或多个海外参考监管机构的市场授权,则有资格获得Abridged简化、Expedited加速和Immediate即时审核途径(文件要求较少,审查时间缩短,费用较低):
美国FDA
欧盟公告机构(EU NB)
加拿大卫生部(HC)
澳大利亚(TGA
日本厚生劳动省(MHLW)
质量体系要求
国际认可机构颁发的ISO 13485证书、MDSAP证书、符合美国FDA质量体系规定或日本MHLW质量体系认证声明。
临床数据
与产品预期用途、风险等级相适应的临床数据,HSA可接受其他国家的临床数据。
医疗器械产品不同分类及注册路径所需要的时间及费用不同。例如A类产品可以免予注册,时间最短、费用也最低。
对于中高风险产品,注册时间可能需要100+至200+天,官方费用根据注册的路径不同大约需要1-3万人民币;而对于高风险产品,注册时间可能需要200+至300+天,官方费用根据注册的路径不同大约需要3-6万人民币。
本公司相同产品或需要共同使用的产品,可以以Grouping形式注册,节约注册成本及时间。
盛恩医药,精通各国认证法规,熟悉各国认证流程,注册事务具体服务包括:欧盟CE、美国FDA、巴西ANVISA、国内NMPA(分类界定、属性界定、创新申报、型检、临床方案CRO、同品种CER、产品注册)以及其他北美、欧洲、南美、东南亚、亚太地区法规注册认证咨询及定制化服务。
针对国产医疗器械的“走出去”需求,盛恩医药根据不同的海外市场,针对不同企业的不同开发阶段、不同产品的情况,可提供定制式解决方案,帮助企业顺利出海。
针对进口产品寻求中国上市支持需求,基于中国的政策法规及盛恩医药的经验积累,可为进口产品提供全流程服务,帮助进口产品顺利上市。
关于我们
盛恩医药是一家专注于医疗器械注册咨询及临床试验服务的CRO组织,提供CRO、SMO、第三方稽查、独立影像评估服务、FA咨询等服务。公司核心团队成员均具有十年以上临床试验项目服务经验及注册咨询服务经验,完成数百项临床试验项目,并成功获得注册证,特别是心血管领域、外周血管领域、骨科领域、神经介入领域、消化科领域、普外科领域、口腔领域、整形美容领域有着丰富的项目经验。公司秉承“诚信服务、合作共赢”的理念,努力提升服务意识,加强医学能力培养,构建完善的项目管理体系,致力成为行业领先的CRO。
相关业务咨询电话
李老师 18790512921
孙老师 13810532341