
临床事件委员会(Clinical Event Committee, CEC)也称为临床终点事件评审委员会(Clinical Endpoint Committee, CEC):是由独立于试验的临床专家组成的评估委员会,CEC委员按照统一的评审标准,对试验预期的终点事件进行判定,以保证试验终点的客观性,避免各中心之间事件判定的偏差,是临床试验质量控制的重要环节之一。
一
CEC的背景和应用


现阶段临床试验中日益推荐使用CEC。如美国食品药品管理局(FDA)和欧洲医药局(EMEA)分别在2001和2005年的指南中推荐使用CEC对终点事件进行评估。CEC在心血管领域的临床试验中应用较多,国外临床试验中CEC的应用率为81.3%[1]。为进一步提高对心血管领域临床试验终点事件结果的判定,美国学术研究联合会(ARC)在2007年3月发行的Circulation杂志上,发表了题为“冠状动脉支架试验的临床终点标准化定义的案例”的文章,就药物支架临床研究终点的选择和定义进行了阐述[2]。从此,心脏介入领域的终点判定的共识变得更加规范化。2011年瓣膜学术研究联盟(VARC)在J Am Coll Cardiol杂志上发表了“经导管主动脉瓣植入临床试验的标准化终点定义:瓣膜学术研究联盟的共识报告”[3],2012年更新了“VARC-2共识”[4],为TAVI手术中终点提供更为标准化的定义。此外,在神经领域、癌症和血液学、妇产科、糖尿病、感染性疾病临床研究中都应用过CEC。
近年来,国内临床试验项目开展日趋丰富,对终点事件判定标准化的要求也不断提高。目前,国内部分临床试验中通过采用相应国际标准来提高判定的准确性。但是,也不是所有的临床试验都需要应用CEC,在某些临床试验中使用CEC对试验终点并无显著影响,而且会产生资源及成本的浪费。那么,什么样的临床试验最需要进行CEC评审呢?目前,国内对于CEC的应用并没有统一的指导原则,根据国际标准及相关报道,对于试验终点为非客观指标判定的事件时通常有必要进行CEC评审,如神经病学、血液学、妇科、骨科、肿瘤、呼吸系统和糖尿病等,由于关于疗效和安全性评价的指标不能单纯依据客观检测的化验单而精确评估,而是依靠多方面的检验指标和临床症状,包括化验单、心电图、CT、QA造影、手术记录、病史等,再结合本领域的临床经验综合考虑后才能得出试验终点的结论。这种情况下的临床试验,各研究中心的研究者对方案中终点事件定义的理解不一致、经验不同、分类标准的理解也不一致,容易产生较大的误差,那么如何准确地进行评估就有着重要意义;而一些具有硬指标的试验中,如终点为全因死亡,则CEC的效用便比较小。
二
CEC的职责


CEC是一个由专家组成的独立于临床试验的委员会,委员会的成员得参加评审的临床试验,且与申办方没有重大的经济利益关系,或从属于核心实验室、研究者等。委员会的成员负责依照方案的界定,用统一的标准对终点事件进行裁定,CEC可以废除多中心试验中研究者对事件的个人评价,确保运用统一的标准正确的评估,避免中心与中心之间事件判定的偏差。
三
CEC的组成


CEC委员必须独立于临床试验,按照临床试验的规模及复杂程度,CEC委员由至少3位(1位主席,2位委员)在本试验指定相关临床研究领域拥有一定经验的专家组成。
除CEC委员外,CEC管理团队在CEC中也起着非常重要的作用,CEC管理团队的工作贯穿始终。专业的CRO公司会承担起CEC管理团队的职责,帮助申办方建立起CEC评审委员会,组织并完成终点事件的评审,并对数据管理部门对于评审结果提出的疑问进行解答。CEC管理团队相对独立,确保达到终点标准的上报事件正确地进行评审。CEC管理团队将努力解决所有申办方有关评审结果的问题,包括必要时提出重新评审。
四
CEC的评审流程



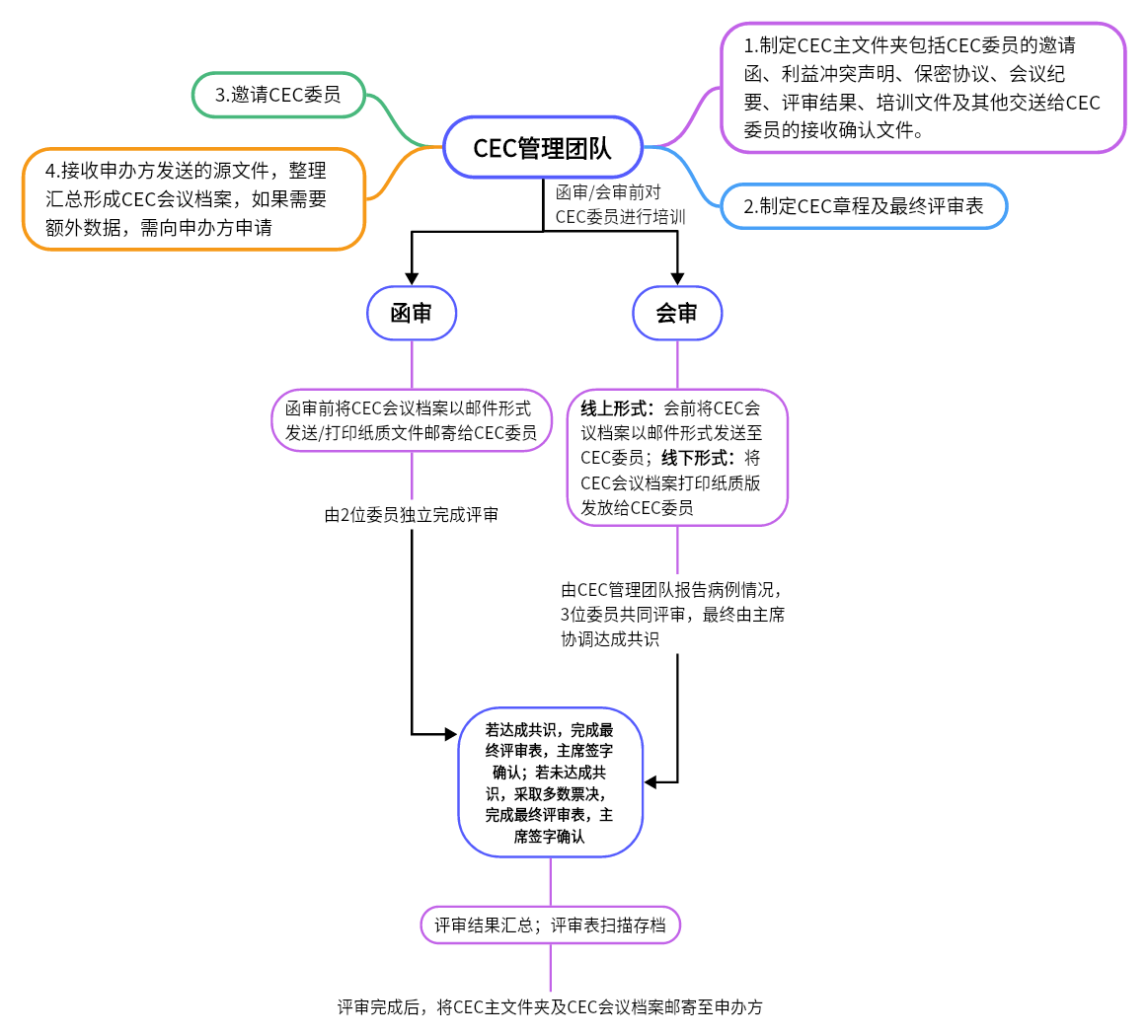

五
CEC评审中的注意事项


1、CEC委员拿到的源文件必须遮盖必要的相关信息,如试验中心、受试者及研究者姓名、使用器械及组别等,确保做到盲审。
2、首次CEC会议申办方可以派出代表参加,以向CEC委员提供方案、事件等培训或提供重要信息等,正式评审开始前必须回避。
3、评审表的设计需依据于方案内容及EDC/CRF的设计,以便后续的结果整理汇总。
4、对于评审过程中,出现委员需要额外的证据而无法完成评审的情况,需在会记纪要中进行说明,会后进行补充申请。
5、CEC主席需出席全部CEC会议,对于意见达成一致的评审结果进行确认并签字。

参考文献:
[1] 王彩虹,赵叶琳,邢君,等. 临床终点委员会在临床事件判定过程中的重要作用. 中国循证医学杂志, 2013, 13(10): 1269-1272.
[2] Cutlip DE, Windecker S, Mehran R, et al. Academic Research Consortium. Clinical end points in coronary stent trials: a case for standardized definitions. Circulation. 2007 May 1;115(17):2344-51.
[3] Leon MB, Piazza N, Nikolsky E, et al. Standardized endpoint definitions for Transcatheter Aortic Valve Implantation clinical trials: a consensus report from the Valve Academic Research Consortium. J Am Coll Cardiol. 2011 Jan 18;57(3):253-69.
[4] Kappetein AP, Head SJ, Généreux P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation: the Valve Academic Research Consortium-2 consensus document. J Am Coll Cardiol. 2012 Oct 9;60(15):1438-54.
关于我们
盛恩医药是一家专注于医疗器械注册咨询及临床试验服务的CRO组织,提供CRO、SMO、第三方稽查、独立影像评估服务、FA咨询等服务。公司秉承“诚信服务、合作共赢”的理念,努力提升服务意识,加强医学能力培养,构建完善的项目管理体系,致力成为行业领先的CRO。
相关业务咨询电话
李老师 18790512921
孙老师 13810532341